こんにちは。なーとし(@naaaaaaato2018)です。
昨今は技術革新のスピードが速く、業界の動向も目まぐるしく変わるようになってきています。
そこで今回は、臨床開発職をしている私が、今後の製薬業界の動向・展望について、医薬品開発の立場から気になるトピックを紹介したいと思います。
技術革新に伴い、劇的に変化する世界では、「自分が本当にやりたかったこと」や、「自分の将来をゆっくり考える」ことも難しいと思います。 今後のキャリア形成に悩む方に向けて、「【新人/若手社員向け】効率的に将来のキャリアプランを考える方法」の記事を書いていますので、合わせてご覧ください。 |
ベンチャー企業の台頭
「【医薬品業界】全世界における開発中製品の7割が、製薬ベンチャー発である!」の記事でも紹介しておりますが、既に世界の71%の医薬品がベンチャー企業発となっています。
販売網を持ってないベンチャー企業がほとんどですから、開発品目を製薬会社へ導出することが基本的な目標になります。
そのため、製薬企業は自社で有用な医薬品シーズを生み出すと同時に、有望なベンチャー企業を見極め、早期の段階で提携するための目利き力も重要になります。
(蛇足ですが、「【医薬品開発】臨床試験から承認までの成功率は9.6%!?」の記事の通り、研究フェーズを超えた医薬品シーズでさえも、臨床試験の突破率は10%未満ですので、改めて開発品目を多く抱えることの重要性を感じます。)
また、ベンチャー企業はいくつかのコアとなる基礎技術をベースに新薬開発を進めているため、医薬品シーズを開発する研究フェーズへの知見は有していても、開発フェーズ(臨床試験)への知見は有していないケースが多いです。
そのため、製薬会社から臨床試験を受諾するCROは、ベンチャー企業が円滑に開発フェーズを実施できるよう、臨床試験に関するサービスは一気通貫で対応できる必要があります。
(逆に言えば、一気通貫で対応できないCROは重要な顧客層を逃すことになります。)
今後もこの傾向はしばらく続くことが予想されます。
製薬企業のスリム化と人材の流動性の高まり
最近の医薬品は高度化、対象患者への個別化が進んでおり、医薬品の研究開発費は高騰しています。
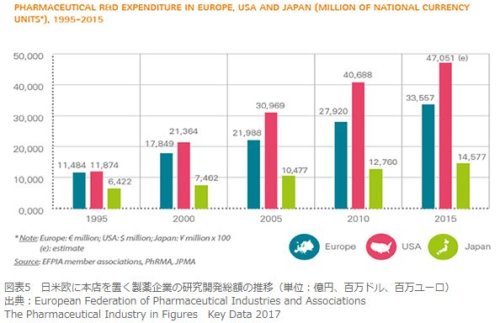
(「過渡期を迎えた製薬企業(前編)〜ふくらむ研究開発費、上がる新薬創出のハードル」より引用)
一方で、特に日本においては薬価制度の改革もあいまって、日本の医薬品市場はマイナス成長することが予測されています。
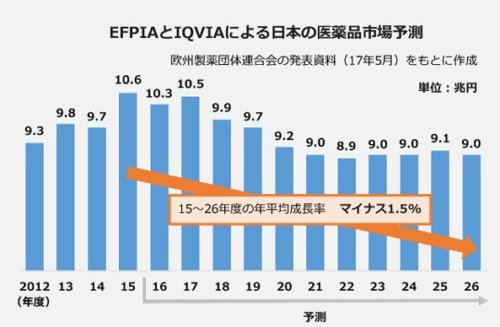
(「【展望2018】製薬企業 戦略再考待ったなし…薬価改革 国内市場マイナス成長に現実味」より引用)
研究開発費が高騰するのに対して、医薬品市場自体はマイナス成長することが予測されるわけですから、日本で売上を上げている製薬企業にとっては、非常に苦しい状況を迎えていることになります。
市場環境の悪化に対応する1つの策として、製薬企業はスリム化を図っています。
また、ベンチャー企業が台頭しているがゆえに、大手製薬企業が有用な開発候補品目をベンチャー企業から導入する傾向は今後も続いていくことが予想されます。
それにより、大手製薬会社の商社化は進んでいくことが予測されます。
(詳しくは、「今後の医薬品業界は(創薬)ベンチャーと(商社化した)メガファーマが増えていく!?」の記事をご覧ください。)
合わせて、製薬会社内の部門の統廃合や、他の会社への譲渡、M&Aが行われることで、引き続き製薬業界の人材の流動性は高まっていくかと思います。
(詳しくは、「【転職のススメ?】研究開発者が流動的に動く未来」の記事をご覧ください。)
デジタル技術を駆使した臨床試験の効率化
高騰する研究開発費を削減するための方法の1つとして、臨床試験の効率化が挙げられます。
臨床試験の効率化に向けて、現在製薬業界全体で取り組んでいることをいくつか紹介したいと思います。
①RBM (Risk Based Monitoring)の導入の加速
日本語に訳すと、「リスクに基づくモニタリング」と言います。
RBMについて簡単に説明しますと、「臨床試験のリスクが発生する時期、病院にリスク発生の重み付けをして、リスクの重みに応じてモニタリング頻度を調整することで、データ品質の向上と効率化を目指す」ことを目的に設定されました。
(かなり大雑把な説明なので、詳しく知りたい方は「リスクに基づくモニタリングとは」や「Risk Based Monitoring(RBM)オーバービュー」をご覧ください。)
このRBMが我々臨床開発職にもたらす影響はもちろん、「CRA業務の効率の向上」になります。
とはいえ、2013年頃から日本でもRBMの話は出ていましたが、2018年時点でも普及率はまだまだ低いのが現状です。
しかし、最近認知度も向上してきたので、普及率が高まるのも時間の問題となりました。
つまり、現在のCRA職として働く人は大勢いますが、ここ5~10年以内に人手が余り始めるのではないかと予測します。
特に日本は、データの確認を細かく行う傾向が強い上に、CRAが本来は病院側がやるべき仕事まで対応してるケースがあるので、RBMの導入に難色を示す方が多いのも、導入が遅れる1つの要因となっているかと思います。
②Virtual Trialの導入
Virtual Trialとは、臨床試験に参加する被験者が病院へ訪問する必要なく、臨床試験に必要なデータがウェブ上でやりとりできるように組まれた治験です。
(Virtual Trialについては、詳しく知りたい方は「Virtual Trial (バーチャル治験)とは?~メリットデメリットから事例紹介まで~」の記事をご覧ください。)
(但し、CTやMRIを使用する臨床試験では、被験者の訪問が必須となるため、数回は被験者の訪問が必要になります。)
Virtual Trialによって、臨床試験の効率化と被験者のコミットメントを高めることが期待されています。
このVirtual Trialについては、既にiMedidataがサービスを開始しているようです。
標的療法が重視される中、医療機関のみで実施される従来型の臨床試験は、費用がますます増加している上、プロトコルがより複雑になっていること、利用できるデータポイントの爆発的増加、治験参加患者の確保といった新たな課題に直面しています。さらには患者とのよりよいエンゲージメント(関わり方)や、試験デザインの個別化など臨床試験への要求事項が増えています。 メディデータのプラットフォームに実装されたバーチャル試験デザインでは、必要な施設ビジットが大幅に減らせる、あるいは不要とできることがすでに示されており、製薬会社は大幅なコスト削減を実現できるとともに、治験参加患者にとっては負担が軽減され、治験により参加しやすくなるというメリットがあります。
被験者側の負担軽減は勿論です。
加えてCRAにとっても、多くのデータを病院へ訪問する前に確認することができますので、病院でモニタリングする際の負担が軽減されます。
(上で紹介したRBMとの相性もいいです。)
またウェブ上で多くのデータを確認できるので、治験薬投与中の有害事象発生をタイムリーに確認することも可能になるケースもあります。
Virtual Trialは臨床試験に関わるあらゆる人を幸せにすると思いますが、現状サービスを提供できる会社も限られているため、少数の会社が一気にVirtual Trialのプラットフォームの覇権を握るかもしれません。
但し、新しいシステムへの順応に時間を要することや、日本のオンライン診療の要件(「6か月間は毎月(あるいは12か月間で6回以上の)対面診療を経た後に実施すること」など)を満たす必要がある等、Virtual Trial導入への課題はあるものの、環境整備と導入には積極的に行われるべきと思います。
(参考資料:医薬産業政策研究所 「政策研ニュース No.55」)
③RWD (Real World Data)の活用
リアルワールドデータ(RWD)とは、臨床現場から得られる匿名化された患者単位のデータのこと。レセプト(診療報酬明細書)や電子カルテがその代表です。
(『「データが変える薬剤の価値」リアルワールドデータが製薬企業にもたらすもの』より引用)
簡単に言いますと、現実世界の情報(対象疾患の患者数、薬剤の使用歴、既往歴、来院頻度など)をまとめたデータベースを活用すれば、今まで見えなかったものが見えるようになり、効率も向上するのではないかというアプローチです。
例えば、臨床試験の費用が高くなる1つの原因として、「一定の期間内に目標とする症例数を登録することができない」ことが挙げられます。
そこで、RWDを活用し、ある病院Aへ通院している対象疾患の患者数を数値化できれば、効率的に症例を登録することができるようになります。
(候補症例数の多い病院へ優先的に臨床試験をお願いすればよいため。)
また、薬剤の個別化(例:○○遺伝子陽性)も進んでいるため、治験薬投与群と対照薬投与群の両群の被験者を集めることは難しくなってきています。
(これは、上で述べた一定期間内に目標症例数を達成できない原因の1つです。)
そこで、「対照群から収集する予定であったデータをRWDから拝借できないか?」というアプローチが最近注目されています。
(「新薬開発 リアルワールドデータで効率化―厚労省がネットワーク構想 民間でもサービス広がる」の記事によりますと、既に欧米ではRWDを対照群とした臨床試験が開始されているようです。)
上記のような背景もあって、日本においても国が主導してRWDの整備・活用に取り組み始めています。
その具体的なアクションとして、MID-NETと次世代医療基盤法の制定が挙げられます。
(詳しくは、「MID-NETと次世代医療基盤法について簡単にまとめてみた」の記事をご覧ください。)
各製薬企業にとって、RWDの活用は死活問題となってきており、ここ数年以内に「RWDを活用した○○」が多く報道されると思います。
Virtual Trialについて、もっと深く知りたい方は「Virtual Trial (バーチャル治験)とは?~メリットデメリットから事例紹介まで~」の記事も合わせてご覧ください。
まとめ
いかがでしたでしょうか?
技術革新のスピードが速いため、ここで書いている内容もあっという間に別の何かに置き換えられてしまう可能性もあるわけですが、2019年初時点で私が思うことを書きました。
少なくとも臨床試験においては、「被験者、病院、製薬会社」全体の負担軽減を目標に動いていくので、臨床試験単体がアップデートしていくというよりも、デバイスの進化やデータ整備、ブロックチェーンの普及など、周辺領域のアップデートに引っ張られて、臨床試験もアップデートしていくと思います。
2019年も色んなアップデートに追いつこうと必死になる予感しかしませんが、キャッチアップできるよう頑張ろうと思います。
ではではまた~。
| 【PR】医薬品業界への就職・転職を希望する方は、「【医薬品業界志望者向け】就活で内定を獲得するためのガイドライン」の記事も合わせてご覧ください。 |